Komisja Europejska stwierdziła, że osiągnęła „ważny kamień milowy” przed przewidywanymi kampaniami szczepień jesienią i zimą
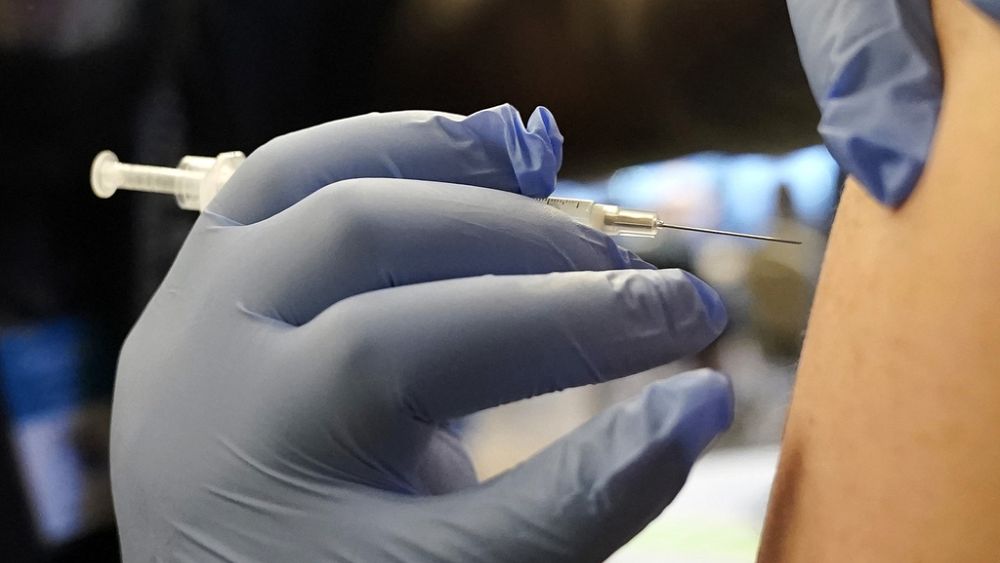
Komisja Europejska zatwierdziła w piątek adaptację szczepionki Covid-19 firmy BionTech-Pfizer przeciwko nowemu podwariantowi wirusa omicron XBB.1.
„Szczepionka jest dopuszczona do stosowania u dorosłych, dzieci i niemowląt w wieku powyżej 6 miesięcy… szczepionka ta stanowi kolejny ważny kamień milowy w walce z tą chorobą” – stwierdził dyrektor UE w oświadczeniu, przypominając, że jest to trzecia aktualizacja programu profilaktycznego .
Oczekuje się również, że aktualizacja szczepionki stosowanej pod nazwą handlową Comirnaty „zwiększy zakres odporności” przeciwko obecnie dominującym i pojawiającym się wariantom.
Zgodnie z wytycznymi Europejskiej Agencji Leków (EMA) i Europejskiego Centrum ds. Zapobiegania i Kontroli Chorób (ECDC) dorośli i dzieci w wieku 5 lat i starsze, które wymagają szczepienia, „powinny otrzymać pojedynczą dawkę, niezależnie od historii szczepień przeciwko Covid-19, – dodała Komisja.
Zezwolenie następuje po „rygorystycznej ocenie” przeprowadzonej przez EMA w ramach mechanizmu przyspieszonej oceny, aby dać państwom członkowskim czas na przygotowanie się do jesienno-zimowej kampanii szczepień.
Modyfikacja umowy z BioNTech-Pfizer podpisana w maju 2023 r. zapewnia państwom członkowskim dalszy dostęp do szczepionek dostosowanych do nowych wariantów wirusa Covid-19 w nadchodzących latach – stwierdził w oświadczeniu europejski dyrektor wykonawczy.






![Vincent van Gogh, Kop van een vrouw (Gordina de Groot) (Head of a Woman [Gordina de Groot]), 1885.](https://tylkogliwice.pl/wp-content/uploads/2024/12/1734223076_Holenderskie-muzeum-kupuje-obraz-Van-Gogha-nazywany-„Mona-Lisa-Brabancji-150x150.jpg)
